اسید سولفوریک (H2SO4)
اسید سولفوریک یک اسید معدنی قوی و فوق العاده خورنده است که به اسید باتری و یا جوهر گوگرد نیز مشهور است. ویژگی مهم سولفوریک اسید، پایداری بالا و توانایی واکنشپذیری با طیف وسیعی از مواد معدنی و فلزی است. از این اسید به عنوان یک ماده اساسی، برای تولید صدها گونه ماده شیمیایی مختلف و مورد نیاز تقریباً همه صنایع از آن استفاده می شود و نقش مهمی در بسیاری از فرایندهای شیمیایی، از جمله تصفیه آب و پساب صنعتی ایفا میکند.
توضیحات محصول
نقش سولفوریک اسید H2SO4 در فرایندهای تصفیه آب و پساب
اسید سولفوریک (H₂SO₄) یکی از پرکاربردترین مواد شیمیایی صنعتی در جهان است که نقش مهمی در بسیاری از فرایندهای شیمیایی، از جمله تصفیه آب و پساب صنعتی ایفا میکند. این اسید قوی به دلیل خاصیت خورندگی و توانایی بالا در تنظیم pH، از جمله مواد پرمصرف در تصفیهخانهها محسوب میشود. در بسیاری از صنایع، کنترل دقیق اسیدیته آب یا پساب برای جلوگیری از تشکیل رسوب، خوردگی یا رشد میکروارگانیسمها ضروری است. استفاده صحیح از سولفوریک اسید میتواند باعث بهبود عملکرد سیستمهای تصفیه و افزایش بازدهی فیلترها و رزینها شود.
تعریف و ویژگیهای کلی سولفوریک اسید
سولفوریک اسید با فرمول شیمیایی H₂SO₄ مایعی بیرنگ، روغنی و بسیار خورنده است که در تماس با آب گرمای زیادی آزاد میکند. این ترکیب بهدلیل قدرت اسیدی بسیار بالا، در صنایع مختلفی همچون تولید کود، مواد شوینده، باتری، و بهویژه در فرایندهای تصفیه آب کاربرد دارد. ویژگی مهم آن، پایداری بالا و توانایی واکنشپذیری با طیف وسیعی از مواد معدنی و فلزی است.
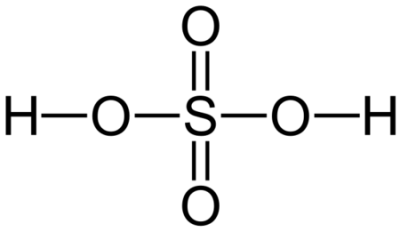
اسید سولفوریک
روش تولید و سنتز اسید سولفوریک (H₂SO₄)
اسید سولفوریک یکی از مهمترین مواد شیمیایی صنعتی است که در صنایع مختلف از کشاورزی تا پالایش نفت کاربرد دارد. مهمترین روش تولید آن فرآیند مجاورت یا تماس (Contact Process) است که به دلیل کارایی بالا و خلوص محصول، رایجترین روش در سطح جهانی است. این فرآیند شامل چهار مرحله اصلی میشود:
۱- استخراج گوگرد
اولین مرحله تولید، استخراج گوگرد خالص از منابع معدنی مانند سنگهای سولفید دار (مانند گالن یا پیریت) و یا از منابع طبیعی گوگرد است. این گوگرد سپس برای مراحل بعدی فرآوری آماده میشود.
۲- تبدیل گوگرد به گوگرد دیاکسید (SO₂)
گوگرد استخراج شده در کورههای مخصوص سوزانده میشود تا با اکسیژن واکنش دهد و گاز گوگرد دیاکسید (SO₂) تولید شود:
S+O2→SO2S + O_2 → SO_2S+O2→SO2
این گاز، ماده اولیه اصلی برای تولید سولفوریک اسید است و باید با خلوص و دمای کنترلشده آماده شود.
۳- تبدیل گوگرد دیاکسید به گوگرد تریاکسید (SO₃)
در این مرحله، گاز SO₂ در حضور کاتالیزور پنتااکسید وانادیوم (V₂O₅) و تحت دمای کنترل شده، به گاز گوگرد تریاکسید (SO₃) اکسید میشود:
2SO2+O2→2SO32 SO_2 + O_2 → 2 SO_32SO2+O2→2SO3
این واکنش در راکتورهای تماس (Contact Reactor) انجام میشود و مهمترین مرحله در فرآیند است، زیرا راندمان تولید اسید به میزان اکسیداسیون SO₂ بستگی دارد.
۴- تبدیل گوگرد تریاکسید به اسید سولفوریک
گاز SO₃ تولید شده با آب غلیظ واکنش میدهد و اسید سولفوریک بسیار قوی و غلیظ ایجاد میکند:
SO3+H2O→H2SO4SO_3 + H_2O → H_2SO_4SO3+H2O→H2SO4
برای کنترل بهتر واکنش و جلوگیری از ایجاد مه اسید، معمولاً SO₃ ابتدا با اسید سولفوریک غلیظ موجود (H₂SO₄ 98٪) ترکیب شده و پیرومونیوم اسید (Oleum) تولید میشود که سپس با آب رقیق شده و به اسید سولفوریک نهایی با غلظت دلخواه تبدیل میشود
نکته فنی:
فرآیند تولید اسید سولفوریک با استفاده از روش مجاورت بسیار کارآمد است، زیرا با کنترل دما، فشار و کاتالیزور میتوان غلظت بالای H₂SO₄ (تا 98–99٪) را با مصرف انرژی بهینه تولید کرد. این روش استاندارد صنعت جهانی برای تولید اسید سولفوریک به شمار میرود.
انواع اسید سولفوریک H2SO4
دو نوع اصلی اسید سولفوریک و ویژگیهای آنها
۱- اسید سولفوریک غلیظ (Concentrated Sulfuric Acid)
اسید سولفوریک غلیظ معمولاً با خلوص نزدیک به ۱۰۰٪ تولید میشود و هنگام گرم شدن، گاز سولفور تریاکسید (SO₃) آزاد میکند. این فرآیند ادامه مییابد تا زمانی که محلول آزئوتروپ با غلظت حدود ۹۸.۵٪ H₂SO₄ ایجاد شود، که نقطه جوش آن حدود ۳۳۷ درجه سانتیگراد است.
این نوع اسید توان واکنش بالایی دارد و میتواند با اکثر فلزات، غیرفلزاتی مانند گوگرد و کربن و حتی برخی نمکها واکنش دهد. برای مثال، وقتی کلرید سدیم (نمک معمولی) با اسید سولفوریک غلیظ واکنش میدهد، گاز هیدروژن کلرید (HCl) آزاد میشود.
یکی از ویژگیهای مهم اسید سولفوریک غلیظ، تمایل بسیار زیاد آن برای واکنش با آب است. به همین دلیل از آن به عنوان عامل خشککننده (Desiccant) استفاده میشود. این ماده میتواند ترکیبات مختلف را بدون آب نگه دارد و با موادی مانند کربوهیدراتها و شکر (C₁₂H₂₂O₁₁) واکنش دهد؛ در این فرآیند، اسید آب موجود در مولکول شکر را جذب کرده و محصولی توده کربنی اسفنجی همراه با سولفوریک اسید رقیق ایجاد میشود. این واکنش مشابه اثر اسید بر پوست، سلولز و مواد گیاهی و حیوانی است.
هنگام رقیق کردن اسید غلیظ، باید همیشه اسید را به آب اضافه کرد، نه بالعکس. زیرا واکنش بین آب و اسید گرمای بسیار زیادی تولید میکند که میتواند باعث جوش آمدن و پاشیدن محلول شود. برای ایمنی، اضافه کردن اسید باید به آرامی و با هم زدن مداوم آب سرد انجام شود تا گرمای حاصل کنترل شود.
۲- اسید سولفوریک رقیق (Diluted Sulfuric Acid)
اسید سولفوریک رقیق از تعیین غلظت دلخواه با افزودن آب به اسید غلیظ به دست میآید. این نوع اسید برای کاربردهایی که غلظت بالا ضروری نیست، مانند فرآیندهای شیمیایی، کشاورزی و صنایع غذایی استفاده میشود.
در حالت رقیق، خطر سوزش و خورندگی کاهش مییابد، اما همچنان قابل اشتعال و واکنشپذیر است و باید با احتیاط نگهداری و استفاده شود. برای رقیقسازی، همانند اسید غلیظ، باید اسید را به آب اضافه کنید، نه برعکس تا از تولید حرارت شدید و پاشیدن محلول جلوگیری شود.
اسید رقیق نیز میتواند با فلزات، مواد آلی و ترکیبات قلیایی واکنش دهد، اما سرعت و شدت واکنش آن به مراتب کمتر از اسید غلیظ است. این ویژگی باعث میشود که استفاده از اسید رقیق برای آزمایشگاهها و مصارف صنعتی کنترلشده ایمنتر و عملیتر باشد.
کاربردهای اسید سولفوریک (H₂SO₄)
اسید سولفوریک یکی از پرمصرفترین مواد شیمیایی در جهان است و نقشی حیاتی در بسیاری از صنایع دارد. بیش از ۶۰ درصد از تولید جهانی این ماده در ساخت کودهای شیمیایی فسفاته استفاده میشود و مابقی در صنایع معدنی، پالایش نفت، متالورژی، مواد شوینده و حتی صنایع غذایی کاربرد دارد. در ادامه، مهمترین موارد مصرف آن را بررسی میکنیم:
۱- کاربرد اسید سولفوریک در شویندهها
اسید سولفوریک به دلیل خاصیت هیدرولیز قوی و توانایی در حل کردن چربیها و لیپیدها، یکی از ترکیبات پایه در تولید شویندههای صنعتی و خانگی است. این ماده به تجزیه و حذف چربیها کمک میکند و در تولید مواد تمیزکننده، صابونها و پاککنندههای صنعتی نقش مهمی دارد. ترکیبات مشتقشده از آن مانند آلکیل بنزن سولفونیک اسید در بسیاری از شویندههای مدرن استفاده میشوند.
۲- کاربرد اسید سولفوریک در کشاورزی
بیشترین حجم مصرف اسید سولفوریک مربوط به صنعت تولید کودهای فسفاته مانند فسفات آمونیوم و سوپرفسفات است. این ماده با واکنش با سنگ فسفات، ترکیبات قابل جذب برای گیاهان تولید میکند. علاوه بر آن، استفاده کنترلشده از اسید سولفوریک در خاکهای قلیایی باعث بهبود نفوذپذیری آب و تهویه خاک میشود. در کشاورزی مناطق خشک (مانند باغهای پسته ایران)، این خاصیت باعث رشد بهتر ریشه و افزایش کیفیت محصول میگردد.
۳- کاربرد اسید سولفوریک خوراکی
در صنایع غذایی، از محلولهای بسیار رقیق سولفوریک اسید به عنوان تنظیمکننده pH و نگهدارنده طبیعی استفاده میشود. این ماده با جلوگیری از رشد باکتریها و قارچها، باعث افزایش ماندگاری مواد غذایی و نوشیدنیها میگردد. در اتحادیه اروپا و برخی کشورها، استفاده از این نوع اسید تحت استانداردهای خاص مجاز است و در تولید شکر، نوشابه و کنسانتره میوهها کاربرد دارد.
۴- کاربرد اسید سولفوریک در پالایش فرآوردههای نفتی
در صنعت پالایش نفت، از اسید سولفوریک با غلظت حدود ۹۳٪ برای تصفیه و بهبود کیفیت فرآوردههای نفتی استفاده میشود. این ماده در فرآیندهایی مانند رنگزدایی، بویزدایی و حذف هیدروکربنهای غیراشباع به کار میرود. همچنین در تولید بنزین آلکیلات، روغنهای سبک و روانکنندههای صنعتی نقش اساسی دارد. نوع خاصی از آن، موسوم به اسید سولفوریک فومینگ (Oleum)، در پالایشگاهها برای دستیابی به فرآوردههای بیرنگ و بیبو استفاده میشود.
۵- کاربرد اسید سولفوریک در تولید مواد منفجره
در صنایع شیمیایی و نظامی، اسید سولفوریک در دو مرحله برای تولید مواد منفجره استفاده میشود: ابتدا در فرآیند نیتراسیون ترکیبات آلی مانند تولوئن و فنل (برای تولید TNT و نیتروفنول)، و سپس به عنوان عامل خشککننده قوی برای تثبیت واکنشها. این خاصیت به دلیل توان بالای اسید در جذب آب و کنترل واکنشهای شدید است.
۶- کاربرد اسید سولفوریک در متالورژی
در صنایع فلزکاری و استخراج فلزات، سولفوریک اسید نقش مهمی در استخراج فلزاتی مانند مس، روی، سرب و نیکل از سنگ معدن دارد. از این ماده برای شستوشوی سنگها، زدودن اکسیدها از سطح فلزات (Pickling) و بازیافت ضایعات فلزی استفاده میشود. کاربرد دیگر آن در تولید الکترولیت باتریهای سرب-اسیدی است که در خودروها و سیستمهای اضطراری انرژی استفاده میشوند.
ضرورت استفاده از سولفوریک اسید در تصفیه آب و پساب
در سیستمهای تصفیه آب صنعتی، معمولاً با چالشهایی مانند pH بالا، قلیائیت زیاد و وجود فلزات سنگین مواجه هستیم. در چنین شرایطی، تزریق مقدار کنترلشدهای از سولفوریک اسید باعث کاهش pH، افزایش راندمان حذف فلزات و بهبود عملکرد فیلترها و غشاها میشود. همچنین، در فرایندهای احیای رزینهای تبادل یونی، H₂SO₄ نقش حیاتی دارد و باعث بازگرداندن ظرفیت جذب رزینها میشود.
کاربرد سولفوریک اسید در تصفیه آب و پساب صنعتی
در این بخش به مهمترین کاربردهای صنعتی و عملی H₂SO₄ در حوزهی تصفیه آب و پساب میپردازیم.
تعدیل pH و تنظیم اسیدیته
اصلیترین کاربرد سولفوریک اسید در تصفیه آب، کاهش pH است. در بسیاری از فرایندهای صنعتی مانند برجهای خنککننده، سیستمهای اسمز معکوس (RO) و بویلرها، pH بالا میتواند موجب رسوبگذاری و کاهش کارایی شود. تزریق کنترلشدهی H₂SO₄ باعث رسیدن pH به محدودهی بهینه (معمولاً بین ۶ تا ۷) میشود و از ایجاد مقیاس کربنات کلسیم جلوگیری میکند.
احیای رزینهای تبادل یونی و تولید مواد شیمیایی کمکی
در سیستمهای تبادل یونی، رزینهای کاتیونی پس از مدتی اشباع میشوند. برای احیای آنها از محلول رقیق سولفوریک اسید استفاده میشود. علاوهبراین، H₂SO₄ در تولید ترکیباتی چون سولفات آلومینیوم و سولفات آهن، که خود از مواد اصلی فرآیند انعقاد و لختهسازی آب هستند، نقش کلیدی دارد.
بازیافت و مدیریت پسابهای اسیدی
در صنایعی مانند تولید فلزات یا باتری، پسابهای حاوی سولفوریک اسید به وجود میآید. این پسابها با استفاده از فناوریهای نوین مانند تبخیر، تقطیر یا تبادل یونی، بازیافت میشوند تا هم هزینه کاهش یابد و هم آلودگی زیستمحیطی کنترل شود.
انتخاب صحیح غلظت و دوزینگ
انتخاب غلظت مناسب H₂SO₄ (معمولاً بین ۱۰ تا ۹۸ درصد) باید براساس دبی جریان، نوع آلودگی و هدف تصفیه انجام شود. استفاده از پمپهای دوزینگ مقاوم به خوردگی و سیستمهای کنترل خودکار برای ایمنی و دقت بیشتر ضروری است.
واکنشهای شیمیایی سولفوریک اسید در آب و پساب
سولفوریک اسید در آب بهطور کامل یونیزه شده و یونهای H⁺ و SO₄²⁻ آزاد میکند. افزایش غلظت یونهای هیدروژن باعث کاهش pH میشود و یون سولفات نیز میتواند در واکنشهای رسوبدهی یا تبادل یونی نقش داشته باشد. این رفتار باعث افزایش قابلیت حذف فلزات سنگین و بهبود کیفیت خروجی آب میگردد.
عوامل مؤثر بر عملکرد
پارامترهایی نظیر دما، غلظت اسید، دبی جریان و ترکیب شیمیایی پساب بر اثربخشی سولفوریک اسید تأثیر مستقیم دارند. استفاده بیش از حد ممکن است باعث خوردگی شدید تجهیزات شود یا تشکیل نمکهای سولفات را افزایش دهد. ازاینرو، کنترل دقیق دوز و پایش مستمر pH ضروری است.
ایمنی و استانداردهای استفاده
به دلیل خاصیت خورندگی بالا، باید از تجهیزات مقاوم مانند لولههای PVC، فایبرگلاس یا تفلون استفاده شود. در هنگام انبارش، مخازن باید در محیط خنک، تهویهدار و دور از مواد قلیایی نگهداری شوند. رعایت استانداردهای ایمنی بینالمللی مانند OSHA و EPA برای کار با این ماده الزامی است.
مزایا و معایب استفاده از سولفوریک اسید
| ویژگی | مزایا | معایب |
|---|---|---|
| کارایی در کاهش pH | بسیار سریع و مؤثر | در صورت دوز زیاد موجب خوردگی میشود |
| هزینه | نسبتاً پایین و در دسترس | نیاز به تجهیزات ضد خوردگی دارد |
| واکنشپذیری | مناسب برای اکثر فلزات و یونها | تولید گاز و گرمای زیاد در واکنش با آب |
| پایداری | بالا در شرایط ذخیرهسازی مناسب | خطرات زیستمحیطی در نشت یا رهاسازی |
مزایا
- عملکرد سریع در تنظیم pH
- در دسترس بودن و قیمت مناسب نسبت به اسید هیدروکلریک
- سازگاری با بسیاری از فرایندهای تصفیه
- امکان استفاده در احیای رزین و تولید مواد شیمیایی ثانویه
معایب و محدودیتها
- خاصیت خورندگی بسیار زیاد
- احتمال تشکیل مقیاس سولفات در دوز بالا
- خطرات ایمنی برای کارکنان
- نیاز به سیستم پایش مداوم
خطرات کار با اسید سولفوریک (H₂SO₄)
اسید سولفوریک یک اسید قوی و خورنده است که در غلظتهای بالا میتواند سوختگی شدید پوست و بافتها ایجاد کند. تماس آن با پوست باعث هیدرولیز پروتئینها و چربیها میشود و آبزدایی از بافتها حرارت تولید کرده و میتواند باعث سوختگی درجه دوم گردد. تماس با چشم یا قرنیه حتی برای چند ثانیه میتواند به آسیب جدی یا نابینایی دائمی منجر شود. به همین دلیل، افراد شاغل در محیطهایی با حضور این ماده باید لباس محافظ، دستکش مقاوم و ماسک ایمنی استفاده کنند.
اسید سولفوریک به دلیل ویژگی قوی بودن اسیدی و آزادسازی یونهای H⁺، میتواند با مواد مختلف به شدت واکنش دهد. حتی چند قطره از اسید سولفوریک غلیظ میتواند باعث آتش گرفتن کبریت شود. بنابراین، ذخیره و نگهداری آن باید با احتیاط و در ظروف غیرواکنشی مانند شیشه یا پلاستیک مقاوم به اسید انجام شود.
محلولهای اسید سولفوریک باید با برچسب هشداردهنده مشخص شوند:
- محلولهای با غلظت برابر یا بالاتر از 1.5 مولار باید با برچسب “خورنده” علامتگذاری شوند.
- محلولهای با غلظت بین 0.5 تا 1.5 مولار باید با برچسب “محرک” نامگذاری شوند.
اقدامات درمانی در صورت تماس با پوست یا چشم:
- شستشو فوری: ناحیه آلوده را با مقدار زیادی آب سرد حداقل به مدت ۱۰ تا ۱۵ دقیقه شستشو دهید تا اسید رقیق شده و حرارت تولیدی کاهش یابد.
- برداشتن لباس آلوده: لباسهای تماس یافته با اسید بلافاصله جدا شود و پوست زیر آن کاملاً شسته شود.
- کمک پزشکی: در صورت ادامه علائم سوختگی، درد شدید یا تماس با چشم، اقدامات پزشکی فوری و مطابق استانداردهای درمان مواد خورنده انجام شود.
نکته ایمنی: حتی محلولهای رقیق اسید سولفوریک نیز خورنده هستند و باید در محیطهای کنترلشده و با استفاده از تجهیزات ایمنی مناسب کار شوند تا از آسیبهای جدی جلوگیری شود.
خرید اسید سولفوریک
سولفوریک اسید بهعنوان یکی از مواد شیمیایی حیاتی در تصفیه آب و پساب صنعتی شناخته میشود. در صورت استفادهی کنترلشده و ایمن، میتواند بهطور مؤثری باعث کاهش pH، بهبود عملکرد سیستمهای تصفیه و صرفهجویی اقتصادی شود. برای انتخاب غلظت، طراحی سیستم دوزینگ و رعایت الزامات ایمنی، مشاوره با متخصصان این حوزه ضروری است.
اگر در حال طراحی یا بهرهبرداری از واحد تصفیه آب صنعتی هستید، پیشنهاد میشود برای انتخاب بهینه مواد شیمیایی و مشاوره فنی، با کارشناسان ما تماس بگیرید.
شرکت آرتا انرژی پایدار به عنوان تامینکننده معتبر اسید سولفوریک، آماده ارائه خدمات به کارفرمایان و صنایع مختلف میباشد. این شرکت امکان تامین مواد شیمیایی صنعتی با کیفیت و خلوص بالا را فراهم کرده و پشتیبانی فنی و مشاوره تخصصی نیز ارائه میدهد.
برای دریافت مشاوره رایگان، استعلام قیمت و ثبت سفارش میتوانید از طریق بخش تماس با ما در وبسایت با کارشناسان شرکت آرتا انرژی تماس بگیرید تا راهنماییهای لازم برای انتخاب و تأمین مواد شیمیایی متناسب با نیاز شما ارائه شود.
سوالات متداول (FAQ)
آیا سولفوریک اسید فقط برای کاهش pH استفاده میشود؟
خیر. علاوه بر کاهش pH، برای احیای رزینها، تولید مواد منعقدکننده و حتی در بازیافت پسابهای صنعتی کاربرد دارد.
چه غلظتی از H₂SO₄ در تصفیه آب استفاده میشود؟
معمولاً بین ۱۰ تا ۵۰ درصد، بسته به نوع سیستم و هدف تصفیه.
آیا سولفوریک اسید باعث خوردگی تجهیزات میشود؟
بله، اگر دوز یا غلظت زیاد باشد. استفاده از مواد مقاوم به خوردگی و کنترل دقیق دوز ضروری است.
آیا میتوان اسید مصرفی را بازیابی کرد؟
بله، با روشهای تبخیر یا تبادل یونی میتوان بخشی از سولفوریک اسید را بازیافت کرد.













